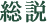独自の加工を施したチタンが生体システムに及ぼす効果:健康と運動能力に対する影響
David S. Rowlands,
School of Sport and Exercise, Massey University, 63 Wallace Street,
Wellington 6140, New Zealand; d.s.rowlands@massey.ac.nz;
要旨
チタンには生体適合性があり、その特徴を生かして幅広い用途に応用されている。最近、ピコ~ナノメーターのサイズの粒子の形態で水に溶解したチタン(アクアチタン)が、健康および運動能力の分野へと用途を広げている。本稿は、アクアチタンで処理した素材に対して生体がどのような生理的応答を示すのかについて、最新の科学的エビデンスをレビューすることを目的としている。アクアチタンによって、単離した海馬神経細胞の膜電位が変化することが試験管内での試験で示されており、この変化によって痛覚記憶緩和が導かれることが示唆されている。正常な筋細胞と骨細胞を、アクアチタンと隣接させたところ、遺伝子発現、たん白質合成、細胞増殖、細胞吸着が亢進したことから、インプラントおよび創傷治癒に対するアクアチタンの臨床応用の可能性が示唆されている。激しい運動で消耗した運動選手の下腿三頭筋にアクアチタンで処理したテープを貼ったところ、筋-腱機能に関する神経調節に有益な効果があり、ランニングエコノミーが改善することを示すエビデンスが得られている。最後に、アクアチタンで囲まれた環境に身を置いた場合に、行動応答と自律神経系に対する影響が認められ、アクアチタンが緊張を緩和し、ストレス抑制応答を促進することが示唆されている。以上の知見を総合すると、アクアチタンで処理した素材に身体を近づける、あるいは接触することによって、神経細胞や筋骨格細胞の増殖および細胞機能の様相が変化し、運動後の筋・腱の回復やストレスに対する全身性応答に有益な影響が現れることが示唆される。
1.緒言
チタンは金属としては比重が軽く、生体に対して適合性があり、重量に比して強度が高いことから、整形外科、歯科および再生医療をはじめ、さまざまなヒトとかかわりのある分野で有用な素材として応用されている[1]。
近年、チタンを高圧下の水中で酸素と水素の混合ガス中で燃焼させ、可燃性ガスに溶かし込む工程を経て、高機能水中に溶解させる技術が発展してきた[2]。チタンに対するこの独自の処理法により、アクアチタン(商標登録済み)と呼称するピコメーターからナノメーターのサイズのチタン粒子が生み出される。この形態のチタンを染料として使用すると、対象の繊維に難なく結合する。そのため、アクアチタンは、衣料、テープ、あるいはその他の素材における重要な構成要素として、我々の生活や環境と密着し、さまざまな用途に応用できる可能性を有する。
現在までに、厳密に実施された研究から、細胞および組織をアクアチタンで処理した素材に接着させる、または接近させることによって、生理的機能の様相が変化することを示唆するエビデンスが得られている。このアクアチタンによる生理応答は、ヒトの健康と運動能力に対して、小~中等度の好影響をもたらす可能性がある。
ピコ~ナノメーターのサイズのチタン粒子でコートした素材と細胞を接近させると、錐体ニューロン細胞では静止膜電位および活動電位発火率が低下し[3]、骨芽細胞ではアルカリホスファターゼ活性、ミネラル沈着、骨関連遺伝子の発現が亢進した[4]。このような試験管内での試験の結果は、チタンまたはチタンをコートした素材が、抗炎症作用や抗酸化作用を有し、神経細胞の増殖を促進するとする過去に報じられた研究と整合する。
ヒトでは、男性の運動選手を対象とした研究で、アクアチタン粒子を含浸した衣料やテープは、過酷な坂道ランニング後の回復期におけるアキレス腱の柔軟性を維持し、反射反応を改善したほか[9]、ランニングエコノミーを改善することがわかっている[10]。一方、アクアチタンで処理した素材を使用した部屋で睡眠した事務職に従事するヒトを対象とした研究では、ストレスの徴候が緩和される[11]。
本稿の目的は、アクアチタンで処理した素材が細胞および組織の機能とヒトおよび動物の行動に及ぼす生物学的作用に関する最新の研究の広がりをレビューすることにある(図1)。
2. 細胞の増殖、吸着および機能
チタンおよびチタン合金は、生体適合性と体内での耐久性を併せ持つという理由から、外科手術の移植材として広く用いられている。チタン製インプラントの体内への移植は、表面の形状と化学組成という2つの特性によって成功に導かれる[12-14]。この2つの特性は、生体内の組織のタイプごとにその重要性が異なる。
アクアチタンで表面をコートしたチタンは、骨格筋細胞の凝集と増殖を促進した。このコートされたチタンは、表面の形状が変わることなく酸素濃度が上昇しており、そのことが生体活性の上昇に寄与していると考えられている[13]。また、表面の化学組成の変化の影響により、ビンキュリン発現の大幅な増加が確認された(図2)。ビンキュリンとは、接着たん白質の一つで、細胞の接着および吸着の開始時に重要な役割を果たすほか、細胞形状の確立や細胞骨格の発達においても不可欠であり[15,16]、細胞の構造と力学的性質を向上させるものである[17,18]。さらに、(コラーゲンI およびIII、ミオシン、トロポニンTなど)その他の重要な構造たん白質の発現が高まり、構造を強化するのみならず、筋細胞の分化を促進し、その機能も高めていた[13]。アクアチタンの長期的効果のほか、組織に対する効果を明らかにするためには、今後さらに試験を重ねる必要がある。
チタン上で培養した骨芽細胞は、高分子を主体とする素材上で培養した骨芽細胞よりも吸着能が強い[13]。また、アクアチタンでコートしたチタン上では、単なるチタン表面よりも骨形成細胞(骨芽細胞)の多くの機能がさらに増幅される[4]。アクアチタンによるピコ~ナノメーターの薄さでのコーティングは、基質の表面の形状に関わらず骨芽細胞の活性(細胞吸着、遺伝子発現、骨化能など)を向上させた[20]。 このような機能の増大は、アクアチタン処理コーティングによるチタン表面の酸素濃度の上昇と相関していた。この試験でみられた骨形成機能の増大は、アクアチタン処理した生体素材の周囲で骨形成が促進されることを示唆しており、骨の固定および修復、歯槽骨と歯の結合および骨再生などの臨床的処置の成績向上をもたらす新たな可能性を示している。
3. 神経応答
チタンは神経に対する高い生体適合性を有し、たとえば二酸化チタンは有髄神経の構造と機能を変化させないこと[21]、チタン製の金属インプラントと神経の接触はいかなる神経毒性ももたらさないこと[22]が知られている。またアクアチタンは、皮膚に貼るテープに導入した場合でも、神経組織に対して無毒性であることが明らかにされている[3]。ルチル型二酸化チタンを用いた培養試験では、中枢神経系の細胞において通常の神経突起の伸長を伴う良好な生存状態を誘導することが示されている[5]。以上のデータから、中枢神経系の移植手術にチタンを使用できる可能性が示唆される。
アクアチタンで処理したテープを皮膚に貼付したとき、痛みの感覚がやわらぐとの事例報告があり、神経応答への影響の可能性が検討されてきた。中枢神経系がかかわる生理的な痛みのメカニズムについて、細胞応答を指標とした試験で検討した[3]。その結果、プラセボテープに比して、アクアチタンはマウスの海馬の錘体ニューロンの長期増強(LTP)を用量依存的に抑制した(図3)。同様の試験を脊髄の背角の疼痛処理経路についても実施した。アクアチタンは背角でも、中枢で痛覚過敏が起きる際の細胞機構の一部であると考えられているLTPを抑制した。この抑制の程度は布地(テープ)に含有されるアクアチタン濃度に依存的であり、アクアチタンの最高濃度で最も強い抑制がみられた。一方、細胞とアクアチタンテープとの間に鉛のプレートを置いたところ、神経細胞に対するアクアチタンの効果は消失した。これらの観察結果は、アクアチタンがシナプスの可塑性を抑制することを示唆しており、痛覚記憶が形成される際に、疼痛に関する感覚の情報を低下させている可能性を示している[3]。他の先行報告では、神経が通常の純粋チタンと接触した際に活動電位が変化する証拠が一切認められなかったのに対して[22]、アクアチタンによる処理によって静止膜電位および活動電位発火率の低下がみられる。以上により、この研究は、アクアチタンテープが神経毒性や副作用を伴うことなく疼痛を緩和させる可能性を初めて示した重要な研究であるといえる。
4. 腱筋および骨格筋の機能
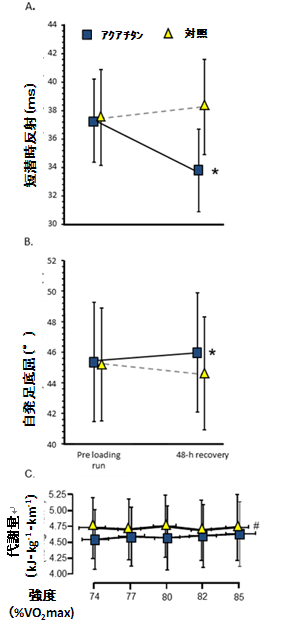
アクアチタンは、手術用インプラントのみならず、衣類やテープ素材にも導入されており、運動性疲労後の回復過程に及ぼす影響についてヒトで検討されている。最近の研究のデータでは、二重盲検試験で、激しいランニング後の回復時にアクアチタンで処理した素材を適用した場合に、対照素材を適用した場合と比べて関節可動域[9,24]、短潜時反射時間(反射反応)およびアキレス腱の柔軟性[9]の回復と、ランニングエコノミーの復調が示唆されている(図4)。
激しい運動を行った結果、痛みや張りを覚える部分に、アクアチタンで処理したテープまたはパッチを貼ると、筋肉および関節の硬直が緩和するという事例報告がある。アクアチタンで処理した衣料が骨格筋の機能に及ぼす効果を検討する前は、その生理作用の機序は全くの推論の域を出ないものであった[24]。そこで、筋および腱に対する生理作用を明らかにすることを目的として、全身を被うナイロンポリエステル衣料にアクアチタンを処理することによって検討した。運動後48 ~72時間の回復過程において、ランニングエコノミーに対する衣料の効果を検討した[9,10,24]。興味深いことに、股関節屈曲、脚伸展および足関節底屈曲のみならず、肩でも可動域の増加がみられたことから[24]、アクアチタンは局所の筋・腱のストレスに対する応答だけでなく、全身的効果があることが示唆された。また、アクアチタンで処理した素材との接触後にみられた関節の柔軟性の改善は、腱機能の変化によるものであることが示唆された[24]。ただし、このような神経および筋・腱の変化に及ぼす生理的機序は未だ明らかではない。
アクアチタンで処理した素材との皮膚接触が筋骨格の機能を向上させる可能性は、Rowlandsによって実証されている[9]。高強度の上り下り(トレッドミル)走行後の回復期間中に、ミクロチタンを含浸した粘着性テープを下腿三頭筋に貼付した。48時間の回復中に、疲労による足関節底屈曲時の可動域縮小とアキレス腱の柔軟性の程度が運動開始前の状態に戻り、下腿三頭筋短潜時反射の顕著な時間短縮がみられたことから、神経筋応答の速度が上昇していると考えられた。この場合の短潜時反射は、受容体からの興奮性入力または抑制性入力に依存し、運動ニューロンの興奮性を変化させる[25]。反射反応時間の短縮は、反射弓を介した神経伝導が早まったことにより末梢の運動制御が向上したことを示唆している[9]。また、この末梢の応答は、求心性神経のネットワークを介して、運動神経中枢に影響を及ぼしていると考えられる。
アクアチタンの効果で短潜時反応が早くなることにより、組織適応とは無関係に歩様の効率が改善すると考えられる。反射潜時が短くなると、収縮に伴う伸張時に筋紡錘が活性化することによって、筋・腱複合体の柔軟性が調整される[27,28]。さらに、筋紡錘およびゴルジ腱器官のグループⅡ線維からのフィードバックが、ランニングの動作の効率に大きく寄与することが示唆された。たとえばランニングのように、動作の前にアキレス腱の顕著な伸展を伴わない運動[30]では、腱の柔軟性を維持すれば、疲労によって収縮システムの能力が減衰するのを抑えられると推察される。また、腱の弾力性の変化や動的神経筋の能力の変化が、ランニングにおける収縮能[26]と代謝効率の改善[10]を説明できる重要な機序であると考えられる。アクアチタンの皮膚接触によって筋・腱の神経機能が変化を受ける機序は明らかではない。しかし、いくつかの作用を推定することはできる。アクアチタン処理した衣料を着用すると、体感温度の心地よさが増すとするランナーの報告があり[24]、これは熱伝導が作用機序のひとつであることを示唆している。チタンの熱伝導率は比較的高く、(水が0.6 W•m−1•K−1 なのに対して)最も一般的なチタン/アルミニウム/バナジウム合金の熱伝導率は5.8 W•m−1•K−1である。このため、アクアチタン処理した素材中のチタンの微粒子は、組織にとっての熱吸収装置として働く可能性がある。体熱は、体温上昇、筋力低下[31]、腱の柔軟性の低下[32]、神経の機能不全などと関連し、さまざまな生理機能に重要な役割を果たす。骨格筋の機能とランニング時の代謝効率の回復に及ぼすアクアチタンの効果を説明しうるもうひとつの機序として、損傷を受けた骨格筋組織の早い修復または再生が挙げられる。過酷な運動を行ったあとに骨格筋線維に損傷が起きると、収縮機能不全とランニングエコノミーの低下が生じるため、ストライドの幅[34]、可動域[36]および膝伸展力[35]が低下し、一歩ごとの効率が低下する。長距離走において中心となって働くⅠ型筋線維が損傷することによって、Ⅱ型筋線維の動員が余儀なくされる。Ⅱ型特異ミオシンATPアーゼのアイソフォームは、力発生の単位当たりに必要なATPがⅠ型の1.6~2.1倍であるため[37]、それに比例して酸化的リン酸化によるATP産生の亢進が必要となる。アクアチタン衣料着用下では、最大下運動時に分時換気量の低下(4%)が認められ、亢進したⅡ型線維の動員を、アクアチタンが部分的に補っていることが考えられる[38]。これは、分時喚起量が活動筋の求心性神経による収縮と連動することから説明することができる[39]。損傷を受けた筋肉は、創傷治癒につながる炎症過程を介して再生と修復を行い、筋形成を活発化させる[40]。既に述べたように、Ishizakiらは培養細胞でアクアチタン処理したラバーがミオシン線維の構成成分の発現を増強し、筋細胞および骨芽細胞の成長を促進することを報告している。このような機序が生体内でも働くとすれば、筋損傷をもたらす運動後にアクアチタンによって筋骨格の収縮機能の回復が早まる機序として、骨格筋細胞および組織の再生が考えられる。
5. 行動および精神的応答
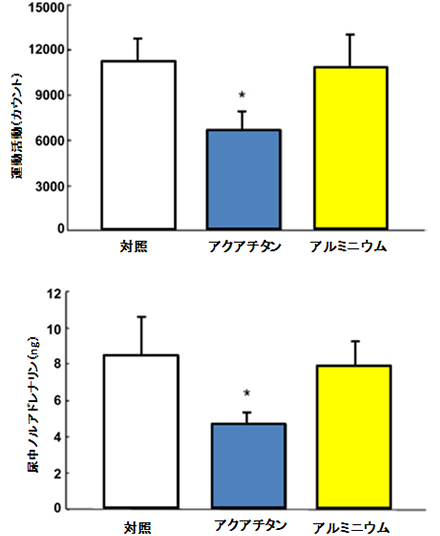
アクアチタンで処理した壁および床の素材の近くに身を置くか、あるいは衣料を着用することが、局所的な環境ストレスに対する生理的応答および行動的応答に何らかの影響を与えることが明らかにされている。Aoiらは、アクアチタンで処理したゴムシートを外側と内側に貼った飼育ケージと、チタンを含まないシート(プラセボ)を貼った飼育ケージを用いて、マウスの自律神経系の活動を比較検討している[41]。心拍変動のパワースペクトル解析による評価と、尿中ノルアドレナリン濃度の低下により、アクアチタン処理は交感神経活動を抑制し副交感神経活動優位に導くことが示された(図5)。また、チタンで囲んだケージで飼育したマウスは、夜間睡眠期において、環境変化によるストレス反応の指標である自発的活動が抑制された(すなわち睡眠時間が増加したことを示す)。一方、アクアチタン処理したゴムシートをアルミフォイルで包むと、この自発的活動の抑制はみられなかった。マウスは通常、ケージ交換後には興奮し、ケージの中での活動が活発になり、睡眠時間が短縮する[42]。これらの観察結果によって、アクアチタンが近くにある環境に身を置くことにより、ストレスに対する生理的応答およびストレスによる齧歯類の行動が抑制されることがわかり、リラックス効果が得られることが示唆された。
この研究グループは、ヒトでもほぼ同じリラックス効果の初期データを得ている[11]。日常的に精神ストレスを感じている事務職の男性24例を無作為化した集団を対象として、齧歯類の試験と同じくアクアチタンで処理したゴムシートの床と壁で構成した部屋内で就寝させ、チタンを含まないプラセボの部屋と二重盲検下で比較した[41]。被験者は日中の労働の終了後クリニックに帰り、各人の部屋で一晩を過ごし、この就労と就寝のパターンを5日間繰り返した。4日目の朝の血中副腎皮質刺激ホルモンおよびコルチゾール濃度が、試験開始時に比してそれぞれ81%および36%と有意に上昇していたが、アクアチタン群ではその変化が小さかった。また、自律神経系の活動を心拍変動によって評価したところ、心室再分極の時間のパワースペクトラム解析(R-Rインターバルのデータ)において、アクアチタンの部屋で過ごした被験者は、試験開始時に比して覚醒時間帯での高周波パワースペクトル比の有意な上昇を示した(14-27%)。これとは対照的にプラセボ群では、覚醒時間帯でも睡眠時間帯でも有意な変化は認められなかった。このパワースペクトラム解析の結果は、アクアチタンで処理した部屋が交感神経活動を抑制し副交感神経活動優位に導いたことを示唆している。このことはコルチゾールの成績からも強く裏付けられた。スペクトラム解析の詳細な検討により、試験期間中にプラセボ群では日中の就労時間帯での交感神経系の活動が漸増していたが、アクアチタン群は試験開始時の水準を維持していることが明らかになった。さらに、心理テスト(POMS)によって心理的ストレス検討したところ、アクアチタンで覆った部屋内で5日間過ごすことにより、プラセボに比べて怒り-敵意の項目の点数が中等度に低下し、活力-活気の項目の点数が逆に上昇した。一方、緊張-不安および怒り-敵意の項目は低下を示した[11]。これらの観察結果は、夜間にアクアチタンに囲まれて過ごすことにより、自律神経が関与する心理的ストレスが中等度に抑制されるものの、日中に過度のリラックスをもたらすわけではないことを示唆している。この試験ではアクアチタンで覆った壁および床と被験者との間が離れていることから、アクアチタンが直接身体に接触していなくても効果を発揮していると考えられる。これは、アクアチタン処理したテープを培養皿の下に据えることによって、錘体神経への影響がみられたとするKorte [3]の試験管内試験の結果と整合する[3]。
日常的にトレーニングしている男性に高強度の試験的サッカーを実施させ、その後の5日間の回復期間中にアクアチタンで処理した衣料を着用した試験においても、心理的効果がいくつか観察されている[24]。回復期間の3日目に、Daily Analyses of Life Demands in Athletes(DALDA)心理試験におけるネガティブなストレス症候の低下と、POMS評価における“怒り”と“尊敬”項目のレベルの上昇を報告している。さらに、3日目と4日目に、アクアチタン群の被験者は心理的安寧感が向上したとの報告があったが、2日目と5日目は明確な影響はみられなかった。アクアチタンのストレス抑制効果の規模を示す数値は、運動、瞑想、サプリメント摂取などにより被験者の気分状態の改善が認められたとするPOMSを用いた試験成績の範囲(4~60%)[43]に収まっており、比較的小さなものであると思われる[11,24]。
以上をまとめると、アクアチタンで処理した素材へ接触または接近することによって生体が何らかの影響を受けるという事例報告を裏付けるエビデンスがいくつか得られている。自律神経応答は、生命活動に必須の循環器系応答、神経内分泌系応答、疼痛応答および行動応答に不可欠なものであるとともに、高血圧および糖尿病などの疾患に関与するため、ヒトの健康にとって重要なものである[44]。さらに、不眠症は、自律神経失調症と、日常生活と職場での重大な問題を引き起こす高度な精神的ストレスに関係している[45,46]。
6. 結論
マウスやヒトにおける神経調節を介した緊張緩和効果や筋・腱機能の回復効果を示す試験成績により、アクアチタンは健康と運動能力の増進に関するさまざまな可能性を有することが裏付けられている。アクアチタンテープによる錐体ニューロンの長期増強の低下と静止膜電位変化は、単に痛覚記憶の低下の機序を説明するだけでなく、アクアチタンがさまざまな神経機能を変化させる可能性をも示唆している。このほかアクアチタンは、神経筋経路を介して関節の硬さと関節可動域を調整している可能性がある。したがって、アクアチタンが交感神経および副交感神経に対しても同じ効果を及ぼして神経の活動を変化させ、そのことが情動ストレスの緩和をもたらし、自律神経系によって制御される(たとえば血圧および血流などの)生理的応答に対する効果を高める可能性がある。細胞増殖の亢進と筋・腱機能の効率上昇に関するエビデンスは、アクアチタンが消耗の激しい過酷な運動後の筋肉の回復を促進する可能性を示唆している。アクアチタンで処理した生活空間および職場環境や、衣料およびテープなどに対する長期間の接近または接触が及ぼす影響の大きさと臨床的効果を明らかにするためには、さらに研究が必要である。また、さまざまな分野への応用を発展させていくためには、物理的機序および生理的機序を明らかにする研究を実施し、エビデンスの基盤を強化していく必要がある。
健康と運動能力に関連する生理的応答に対してアクアチタン処理素材が及ぼす効果のまとめ。研究で証明された効果(実線矢印)と予想される効果(破線矢印)。各生理的応答を色分けして示した。アクアチタン処理素材(グレー)が及ぼす細胞と組織に対する効果(グリーン)、神経および行動に対する効果(ブルー)、筋骨格に対する効果(オレンジ)である。
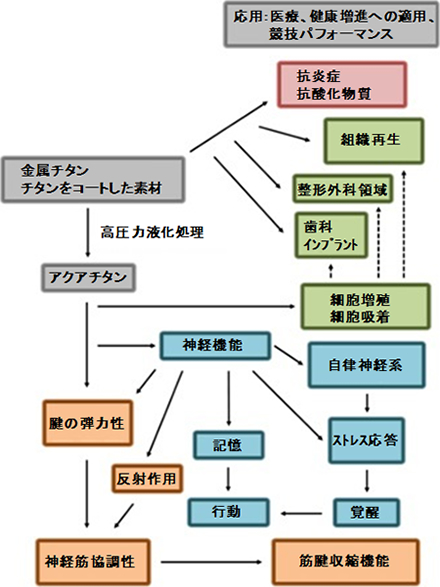
アクアチタン処理あるいは非処理のコート上における細胞培養開始24時間後の細胞骨格および接着の様子。細胞のアクチンフィラメント(赤)およびアンチビンキュリン(緑)をローダミンファロイジンにて染色した共焦点顕微鏡像である。アクアチタン処理したチタン表面上の細胞の方が明らかに大きく、細胞質の伸展も進んでいる。また、アクアチタンコートの方がアクチンおよびビンキュリンの発現が速やかであった。
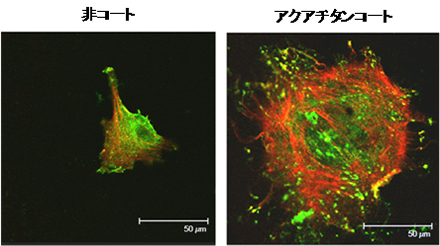
マウスのCA1海馬錐体ニューロンを3種類の濃度のアクアチタン(ATT)を含浸させたテープとプラセボテープに近接させたときの効果。(A)100Hzの刺激に対する応答の長期増強、(B)静止膜電位、(C)活動電位発火率の周波数。データは平均値±標準誤差で示した。いずれの実験にも12枚の海馬切片を用いた。
過酷な運動後の回復期48時間の間、下腿三頭筋と筋・腱の複合領域の皮膚上にアクアチタンで処理したテープを貼ったときと、アクアチタンで処理した全身を被う衣料を着用したときの(A)アキレス腱の叩打による短潜時反射時間、(B)動力測定法による足底屈曲の可動域(ROM)[9]、(C)その後のランニングにおける代謝量に対する影響。データは平均値±標準偏差で示した。p<0.05のときに対照との間に統計学的有意差があるものとした。*は運動前後の比較で有意差がみられたことを示す。#は反復測定線形混合モデルの分散分析から推計したランニングの全行程における差を示す。短潜時反射時間への効果量は大きく、可動域(ROM)および代謝コストにおける効果量は小さなものであった。
アクアチタン処理ケージが、ケージ交換後の自発的活動と尿中ノルアドレナリン含量に及ぼす影響。自発的活動は明期(睡眠期)での各マウスの12時間当たりの運動カウントの積算値により評価した。ノルアドレナリンは24時間中に採取した尿の総含量で示した。データは平均値±標準誤差で示した(n=8)。p<0.05で統計学的有意差がありとした[41]。
謝辞
研究資金の支援をファイテン株式会社(日本、京都市)から受けた。
利益相反
著者にはいかなる利益相反もない。
参照
- Buettner, K.M.; Valentine, A.M. Bioinorganic chemistry of titanium. Chem. Rev. 2012, 112, 1863-1881.
- Hirata, Y.; Ueda, Y.; Takase, H.; Suzuki, K. High functional water containing titanium and method and apparatus for producing the same. NZ Patent 522431, filed 29 November 2000, and issued 1 October 2004.
- Korte, M. Influence of aquatitan tape in nerve cells of the central nervous system. J. Clin. Biochem. Nutr. 2008, 43 (Suppl), 44-47.
- Sugita, Y.; Ishizaki, K.; Iwasa, F.; Ueno, T.; Minamikawa, H.; Yamada, M.; Suzuki, T.; Ogawa, T. Effects of pico-to-nanometer-thin TiO2 coating on the biological properties of microroughened titanium. Biomaterials 2011, 32, 8374-8384.
- Carballo-Vila, M.; Moreno-Burriel, B.; Chinarro, E.; Jurado, J.R.; Casan-Pastor, N.; Collazos-Castro, J.E. Titanium oxide as substrate for neural cell growth. J. Biomed. Mater. Res. A 2009, 90, 94-105.
- Overgaard, L.; Danielsen, N.; Bjursten, L.M. Anti-inflammatory properties of titanium in the joint environment. An experimental study in rats. J. Bone Joint Surg. Br. 1998, 80, 888-893.
- Sahlin, H.; Contreras, R.; Gaskill, D.F.; Bjursten, L.M.; Frangos, J.A. Anti-inflammatory properties of micropatterned titanium coatings. J. Biomed. Mater. Res. A 2006, 77, 43-49.
- Suzuki, R.; Muyco, J.; McKittrick, J.; Frangos, J.A. Reactive oxygen species inhibited by titanium oxide coatings. J. Biomed. Mater. Res. A 2003, 66, 396-402.
- Rowlands, D.S. Uniquely processed titanium permeated tape increases Achilles tendon compliance and short latency response following running. Med. Sci. Sports Exerc. 2012, 44(5S), 634.
- Rowlands, D.S.; Graham, D.F.; Wadsworth, D.P.; Fink, P.W.; Hughes, J.D. Effect of whole-body microtitanium-treated garments on metabolic cost of exercise following strenuous hill running. J.
- Sci. Med. Sport 2013, doi: 10.1016/j.jsams.2013.03.003. [Epub ahead of print].
Aoi, W.; Kamata, T.; Ishiura, Y.; Tomaru, M.; Satoh, Y.; Hitomi, Y.; Uchida, K.; Naito, Y.; Yoshikawa, T. Titanium-treated surroundings attenuate psychological stress associated with autonomic nerve regulation in office workers with daily emotional stress. Physiol. Behav. 2012, 108, 13-18.
- Choudhary, S.; Berhe, M.; Haberstroh, K.M.; Webster, T.J. Increased endothelial and vascular smooth muscle cell adhesion on nanostructured titanium and CoCrMo. Int. J. Nanomedicine 2006, 1, 41-49.
- Ishizaki, K.; Sugita, Y.; Iwasa, F.; Minamikawa, H.; Ueno, T.; Yamada, M.; Suzuki, T.; Ogawa, T. Nanometer-thin TiO2 enhances skeletal muscle cell phenotype and behavior. Int. J. Nanomedicine 2011, 6, 2191-2203.
- Masuda, T.; Yliheikkila, P.K.; Felton, D.A.; Cooper, L.F. Generalizations regarding the process and phenomenon of osseointegration. Part I. In vivo studies. Int. J. Oral Maxillofac. Implants 1998, 13, 17-29.
- Goldmann, W.H.; Ingber, D.E. Intact vinculin protein is required for control of cell shape, cell mechanics, and rac-dependent lamellipodia formation. Biochem. Biophys. Res. Commun. 2002, 290, 749-755.
- Humphries, J.D.; Wang, P.; Streuli, C.; Geiger, B.; Humphries, M.J.; Ballestrem, C. Vinculin controls focal adhesion formation by direct interactions with talin and actin. J. Cell Biol. 2007, 179, 1043-1057.
- Arnesen, S.; Mosler, S.; Larsen, N.; Gadegaard, N.; Purslow, P.; Lawson, M. The effects of collagen type i topography on myoblasts in vitro. Connect. Tissue Res. 2004, 45, 238-247.
- Beier, J.P.; Klumpp, D.; Rudisile, M.; Dersch, R.; Wendorff, J.H.; Bleiziffer, O.; Arkudas, A.; Polykandriotis, E.; Horch, R.E.; Kneser, U. Collagen matrices from sponge to nano: New perspectives for tissue engineering of skeletal muscle. BMC Biotechnol. 2009, 9, 34.
- Saruwatari, L.; Aita, H.; Butz, F.; Nakamura, H.K.; Ouyang, J.; Yang, Y.; Chiou, W.A.; Ogawa, T. Osteoblasts generate harder, stiffer, and more delamination-resistant mineralized tissue on titanium than on polystyrene, associated with distinct tissue micro- and ultrastructure. J. Bone Miner. Res. 2005, 20, 2002-2016.
- Ogawa, T.; Nishimura, I. Different bone integration profiles of turned and acid-etched implants associated with modulated expression of extracellular matrix genes. Int. J. Oral Maxillofac. Implants 2003, 18, 200-210.
- Onur, M.A.; Cehreli, M.C.; Tas, Z.; Sahin, S. Effects of machined/turned, TiO2-blasted and sandblasted/acid-etched titanium oral implant surfaces on nerve conduction: A study on isolated rat sciatic nerves. J. Biomed. Mater. Res. Part B Appl. Biomater. 2003, 67, 772-778.
- Cehreli, M.C.; Onur, M.A.; Sahin, S. Effects of hydroxyapatite-coated and commercially pure titanium oral implant surfaces on compound nerve action potentials. Clin. Oral Implants Res. 2003, 14, 269-272.
- Sandkuhler, J. Learning and memory in pain pathways. Pain 2000, 88, 113-118.
- Wadsworth, D.P.; Walmsley, A.; Rowlands, D.S. Aquatitan garments extend joint range of motion without effect on run performance. Med. Sci. Sports Exerc. 2010, 42, 2273-2281.
- Hultborn, H.; Meunier, S.; Pierrot-Deseilligny, E.; Shindo, M. Changes in presynaptic inhibition of ia fibres at the onset of voluntary contraction in man. J. Physiol. 1987, 389, 757-772.
- Ishikawa, M.; Komi, P.V. The role of the stretch reflex in the gastrocnemius muscle during human locomotion at various speeds. J. Appl. Physiol. 2007, 103, 1030-1036.
- Cronin, N.J.; Carty, C.P.; Barrett, R.S. Triceps surae short latency stretch reflexes contribute to ankle stiffness regulation during human running. PLoS ONE 2011, 6, e23917.
- Kay, A.D.; Blazevich, A.J. Isometric contractions reduce plantar flexor moment, achilles tendon stiffness, and neuromuscular activity but remove the subsequent effects of stretch. J. Appl. Physiol. 2009, 107, 1181-1189.
- Mazzaro, N.; Grey, M.J.; Sinkjaer, T. Contribution of afferent feedback to the soleus muscle activity during human locomotion. J. Neurophysiol. 2005, 93, 167-177.
- Lichtwark, G.A.; Wilson, A.M. Is achilles tendon compliance optimised for maximum muscle efficiency during locomotion? J. Biomech. 2007, 40, 1768-1775.
- Rall, J.A.; Woledge, R.C. Influence of temperature on mechanics and energetics of muscle contraction. Am. J. Physiol. Reg. Int. Comp. Physiol. 1990, 259, R197-R203.
- Ettema, G.J.C.; Huijing, P.A. Skeletal muscle stiffness in static and dynamic contractions. J. Biomech. 1994, 27, 1361-1368.
- De Vrind, H.; Wondergem, J.; Haveman, J. Hyperthermia-induced damage to rat sciatic nerve assessed in vivo with functional methods and with electrophysiology. J. Neurosci. Methods 1992, 45, 165-174.
- Braun, W.A.; Dutto, D.J. The effects of a single bout of downhill running and ensuing delayed onset of muscle soreness on running economy performed 48 h later. Eur. J. Appl. Physiol. 2003, 90, 29-34.
- Eston, R.G.; Mickleborough, J.; Baltzopoulos, V. Eccentric activation and muscle damage: Biomechanical and physiological considerations during downhill running. Br. J. Sports Med. 1995, 29, 89-94.
- Hamill, J.; Freedson, P.; Clarkson, P.; Braun, B. Muscle soreness during running-biomechanical and physiological considerations. Int. J. Sport Biomech. 1991, 7, 125-137.
- Reggiani, C.; Bottinelli, R.; Stienen, G.J.M. Sarcomeric myosin isoforms: Fine tuning of a molecular motor. Physiology 2000, 15, 26-33.
- Franch, J.; Madsen, K.; Djurhuus, M.S.; Pedersen, P.K. Improved running economy following intensified training correlates with reduced ventilatory demands. Med Sci Sports Exerc. 1998, 30, 1250-1256.
- Dempsey, J.A. Bayliss-starling memorial lecture – 2012 “new perspectives concerning feedback influences on cardio-respiratory control during rhythmic exercise and on exercise performance”. J. Physiol. 2012, 590, 4129-4144.
- Tidball, J.G.; Villalta, S.A. Regulatory interactions between muscle and the immune system during muscle regeneration. Am. J. Physiol. Reg. Int. Comp. Physiol. 2010, 298, R1173-R1187.
- Aoi, W.; Takanami, Y.; Kawai, Y.; Otsuki, T.; Kawake, T.; Naito, Y.; Yoshikawa, T. Relaxant effect of microtitan via regulation of autonomic nerve activity in mice. Life Sci. 2009, 85, 408-411.
- Shibakusa, T.; Iwaki, Y.; Mizunoya, W.; Matsumura, S.; Nishizawa, Y.; Inoue, K.; Fushiki, T. The physiological and behavioral effects of subchronic intracisternal administration of TGF-beta in rats: Comparison with the effects of CRF. Biomed. Res. 2006, 27, 297-305.
- Zeidan, F.; Johnson, S.K.; Diamond, B.J.; David, Z.; Goolkasian, P. Mindfulness meditation improves cognition: Evidence of brief mental training. Conscious. Cogn. 2010, 19, 597-605.
- Benarroch, E.E. The central autonomic network: Functional organization, dysfunction, and perspective. Mayo Clin. Proc. 1993, 68, 988-1001.
- Roth, T.; Roehrs, T. Insomnia: Epidemiology, characteristics, and consequences. Clin. Cornerstone 2003, 5, 5-15.
- Baglioni, C.; Spiegelhalder, K.; Lombardo, C.; Riemann, D. Sleep and emotions: A focus on insomnia. Sleep Med. Rev. 2010, 14, 227-238.
- Palmer, I. Pathophysiology of the medial ligament of the knee joint. Acta Chir. Scand. 1958, 115, 312-318.
- Sojka, P.; Johansson, H.; Sjolander, P.; Lorentzon, R.; Djupsjobacka, M. Fusimotor neurones can be reflexly influenced by activity in receptor afferents from the posterior cruciate ligament. Brain Res. 1989, 483, 177-183.
Posted on 2014/08/25